主页 > 新闻中心 > 公司新闻 > 关爱男性健康,重视男性不育
关爱男性健康,重视男性不育

国内外大量的社会调查与医学统计显示:越来越多的疾病正快步向男性走来,并不断地严重威胁到男性同志的身心健康。例如前列腺炎(20-50岁的男性发病率高达20%-40%以上)、性功能障碍、前列腺增生、高血压、糖尿病、疲劳综合症、肥胖综合症、脱发、秃顶等等。这些危害男性健康的现状早已引起国际卫生组织的高度重视。
而男性不育问题也是本世纪仅次于肿瘤和心脑血管病的第三大疾病,在“二胎”政策之后,成为了困扰夫妻双方身心健康的世界性问题。

世界顶级期刊Nature reviews. Urology近期针对男性不育的遗传学因素做了详细整理,男科是一个多学科的医学领域,结合内分泌学、泌尿学和遗传学。男性不育是一种复杂的多因素病理状态,患者表型从睾丸中完全没有精子到精子质量的明显降低,具有高度异质性。遗传因素至少占男性不育症的15%,且对男性不育症的所有四个主要病因分类都有贡献: 生精数量缺陷,导管阻塞或功能障碍,下丘脑垂体轴干扰和生精质量缺陷。


1. Male infertility is a complex multifactorial pathological condition in which genetic factors have roles. Men with azoospermia are at the highest risk of being carriers of genetic anomalies (25%), whereas this risk progressively decreases with increasing sperm output.
在无精症患者中,遗传缺陷的比例是很高的,达到了25%。且随着精液中精子数量的增加,这种遗传因素的占比逐步降低。
2. Karyotype analysis, screening for azoospermia factor (AZF) microdeletions, and screening for mutations in candidate genes are part of the diagnostic work-up of male infertility.
在男性不育的临床诊断中,最常用的即核型分析,AZF微缺失分析,以及常见的基因突变筛查。一些遗传因素与生殖功能受损具有明显的因果关系的变异,已经成为男性不育日常诊断的一部分。这些检测能够为大于20%的男性不育症提供遗传诊断。
3. Genetic testing has three objectives: diagnosis, prognosis before testicular sperm extraction (TESE), and personalizing therapy.
基因检测有三个目标:诊断、睾丸活检精子提取(TESE)前的预后和个体化治疗。
4. AZF deletion testing must be performed before TESE, as complete deletions of the AZFa and AZFb regions cause azoospermia with virtually zero chance of sperm recovery using testis biopsy.
TESE前必须进行AZF缺失检测,因为AZFa和AZFb区域的完全缺失会导致无精子症,通过睾丸活检,精子恢复的机会几乎为零。
5. Genetic anomalies involved in male infertility can also affect general health; thus, long-term follow-up monitoring of patients should be conducted. Furthermore, a possible link exists between infertility and the higher morbidity and lower life expectancy that is observed in infertile men than in the general population.
男性不育中涉及的遗传异常也会引起其他健康问题;因此,应对患者进行长期随访监测。
6. The aetiology of primary testicular failure is unknown in about 40% of men (idiopathic infertility), and genetic factors that have not yet been identified are likely to contribute to a large proportion of these instances. Whole-exome or whole-genome analyses are promising tools for the discovery of the missing genetic aetiology.
约有40%的男性(特发性不育症),不育病因尚不清楚,而这些病例的大部分可能是由于尚未确定的遗传因素决定。全外显子或全基因组分析可以用来发现未知的遗传学原因。

染色体异常
核型分析是第一个在生精数量缺陷的患者中进行的遗传检测,因为大约15%的非阻塞性无精症患者和4%的中度少精症患者(每毫升少于1000万个精子)存在染色体异常。此外,这种基因测试也适用于有反复流产、畸形、认知发育障碍或不育症家族史的男性。非阻塞性无精症中最常见的染色体异常是Klinefelter综合征及其变异(47,XXY和46,XY/47,XXY嵌合)。
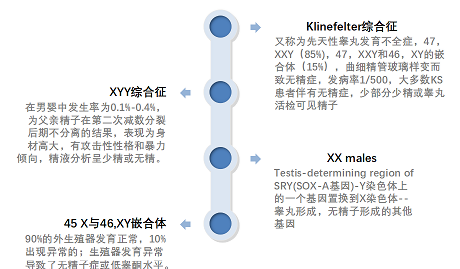
男性不育常见染色体异常
年龄是Klinefelter综合征无精患者睾丸精子提取最重要的预测因素,因为31岁以下男性的成功率明显较高。显微外科睾丸精子提取术(microTESE)与传统的TESE技术相比,具有更高的精子提取率(~50%)。对Klinefelter综合征患者的精子通过胞浆内精子注射(ICSI)得到的胚胎进行植入前遗传诊断(PGD)显示,与那些通过PGD的夫妇产生的胚胎相比,Klinefelter综合征患者正常胚胎的发生率明显降低(54.0% vs . 77.2%)。因此ICSI加PGD也只能适当地预防Klinefelter综合征导致的胚胎性染色体或常染色体异常。这种综合征在患者年轻时得到早期诊断是明显更有利的,因为可以提早冷冻保存睾丸精子,来保存生育能力以及开始预防治疗其他相关的非生殖健康问题。因此,Klinefelter综合征患者应该在他们的一生中监测潜在的合并症。
Y染色体微缺失
Y 染色体长臂(Yq)常染色体质区还存在精子发生相关基因,称为无精子因子(Azoospermia factor, AZF),AZFa、AZFb 和AZFc 3 个区域内至少有15 个与精子发生相关的基因, 且每个区域均有相应候选基因或基因家族。作为第二大因素,Y染色体AZF区微缺失占Yq微缺失的87%。核型分析的分辨率不够,只能看到>5M的结构异常,因此国际上重用的微缺失检测方法为多重荧光毛细管电泳,针对AZFa,AZFb,AZFc三个区域的STS位点,检测缺失与否。

Y染色体AZF区
非阻塞性无精症患者的基因检测可以帮助他们在TESE前做出决定。例如,对于一个46岁,XX男性或是携带着巨大结构异常Y染色体,并且丢失了所有三个AZF区域的人来说,TESE不应该被应用。Y染色体微缺失的分子遗传筛选(AZF缺失screening)对于精子提取具有预后价值,这取决于缺失的类型。AZFa区域最小,只包含两个蛋白编码基因,但其完全缺失导致最严重的表型SCOS。然而,部分AZFa缺失,仅去除USP9Y,精子是可以产生的。AZFb和AZFbc的缺失在大小和基因量上都是最大的,这些区域的缺失与精母细胞阻滞有关。重要的是,完善这些缺失的定义是至关重要的。因为有报道,在AZFb部分缺失的情况下,睾丸中有残余精子生成。因此,实验室应使用适当的扩展标记,以便准确区分部分和完整的AZFb缺失。
CFTR突变检测
导管梗阻或功能障碍是指任何对精子运输系统的干扰,可在泌尿生殖道(近端和远端)发生。这些改变可能导致少精症或无精症,并以正常睾丸组织学为特征。目前唯一已知由遗传导致的形式是先天性输精管(CAVD)缺失伴肾发育正常,而与CAVD伴单侧肾发育不全相关的遗传因素尚不清楚。
CAVD不伴单侧肾功能不全,在大多数病例(~80%)中是由CFTR纯合或复合杂合突变引起。此基因位于人类的第7号染色体上,其编码的膜蛋白是一种Cl-离子通道蛋白,受AMP的调控。

CFTR基因在7号染色体的位置
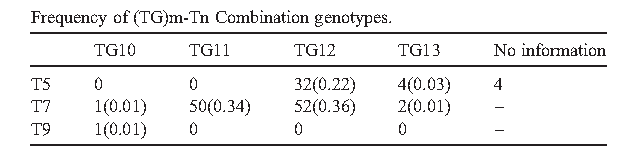
国外做了大量的CFTR基因突变与先天性双侧输精管缺如关系的研究,从1990年,在CBAVD中发现第一个CFTR突变2,已知的CFTR基因突变已达1900多种,并且还在不断增加。CBAVD患者中一般都携带1个或者更多CFTR突变,大约35%的患有先天性输精管缺如的伊朗男性带有一个可检测到的CFTR突变,约40%带有两个(一般的CFTR突变或者IVS8-5T多态位点)3。约27%的先天性输精管缺如的克罗地亚男性含5T变异。位于内含子8和外显子9连接处的poly T 和TG重复均不同程度影响剪切,导致外显子跳跃,从而改变了CFTR蛋白的正常表达,如内含子8的多态性(Tn)等位基因T5与TG11,TG12,TG13多态性等位基因连锁导致CBAVD发生4。
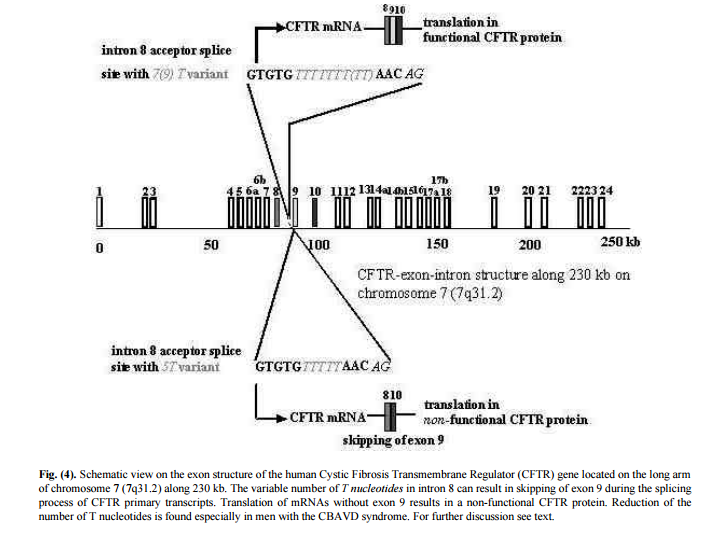
CFTR第8内含子上poly-T突变导致第9外显子跳跃
阻塞性的无精症,TESE可以被应用。但在ICSI之前明确妻子是否也携带CFTR基因突变同样重要,可防止相同突变的存在而导致后代出现纯合患病个体的可能发生。
在过去的25年里,分子遗传工具使男性不育症的遗传诊断取得了重要进展。具体来说,在Y染色体研究方面取得的进展,无论是Yq相对高频率的缺失,还是对精子生成的影响,都对改善临床实践做出了很大的贡献。
在目前辅助生殖技术盛行的时代,排除了卵子受精的自然屏障之后,诊断男性不育症的遗传原因具有明显的临床意义,因为它将对生殖健康领域和患者及其子女的健康产生积极的影响。同时,它对睾丸取精也具有一定的预后价值。此外,在不久的将来,一些遗传变异的鉴定可能有助于个性化激素疗法(药物遗传学)的开展。因此,男性生殖的医生应该意识到男性不育所有遗传检测的临床意义,以及关注正在进行的男性生殖遗传相关的研究及未来展望。
天昊男性不育体系
基于对男性不育的已知以及未知的因素进行探索,天昊检验综合运用公司专利技术CNVPlex®和SNPScan®,针对Y染色体设置高密度探针120对,覆盖整个染色体PAR1区、PAR2区、高度重复的异染色质区以及Y染色体特异区的主要基因等,同时在X染色体设置探针,不仅在一次实验中完成对X,Y染色体的数目异常检测,且对Y染色体基因缺失和重复突变的拷贝数精确确定,有助于发现非常见的缺失重复突变,对于出现未知原因的拷贝数或重复数变异,将对其父亲进行同步检测,以探究男性不育未知因素。
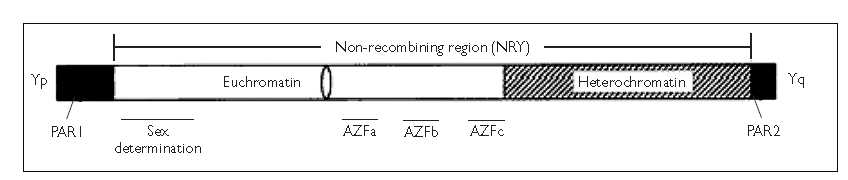
Fig 4---Poongothai J, Gopenath T S, Manonayaki S. Genetics of human male infertility[J]. Singapore Med J, 2009, 50(4): 336-347.

1.Csilla Krausz1,2 & Antoni Riera-Escamilla2 Nature Reviews Urologyvolume 15, pages369–384 (2018)
2.Dumur V, Gervais R, Rigot J M, et al. Abnormal distribution of CF 508 allele in azoospermic men with congenital aplasia of epididymis and vas deferens[J]. The Lancet, 1990, 336(8713): 512.
3.Radpour R, Gourabi H, Gilani M A S, et al. Molecular study of (TG) m (T) n polymorphisms in Iranian males with congenital bilateral absence of the vas deferens[J]. Journal of andrology, 2007, 28(4): 541-547.
4.Groman J D, Hefferon T W, Casals T, et al. Variation in a repeat sequence determines whether a common variant of the cystic fibrosis transmembrane conductance regulator gene is pathogenic or benign[J]. The American Journal of Human Genetics, 2004, 74(1): 176-179.
5.Li H, Wen Q, Li H, et al. Mutations in the cystic fibrosis transmembrane conductance regulator (CFTR) in Chinese patients with congenital bilateral absence of vas deferens[J]. Journal of Cystic Fibrosis, 2012, 11(4): 316-323.